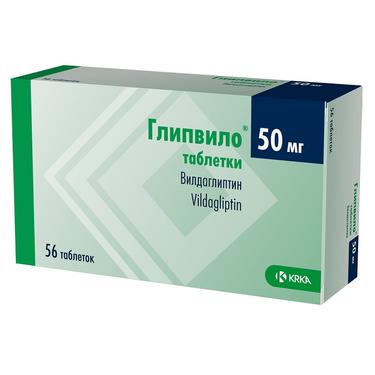
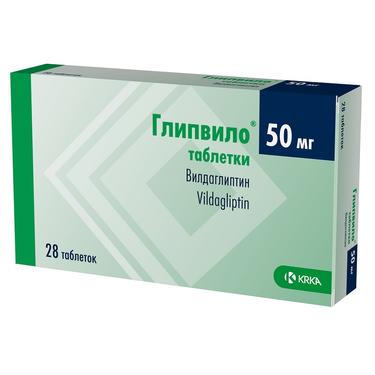
Галвус Мет в Волгограде
3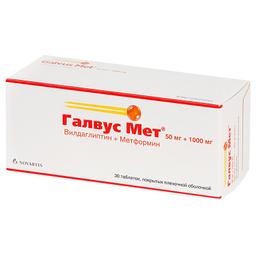

Инструкция по применению Галвус Мет
Общие характеристики

Показания
Сахарный диабет 2 типа у взрослых пациентов в возрасте старше 18 лет (в сочетании с диетотерапией и физическими упражнениями):
- при недостаточной эффективности монотерапии вилдаглиптином или метформином;
- у пациентов, ранее получавших комбинированную терапию вилдаглиптином и метформином в виде монопрепаратов;
- в комбинации с производными сульфонилмочевины (тройная комбинированная терапия) у пациентов, ранее получавших терапию производными сульфонилмочевины и метформином без достижения адекватного контроля гликемии;
- в тройной комбинированной терапии с инсулином у пациентов, ранее получавших инсулинотерапию в стабильной дозе и метформин без достижения адекватного контроля гликемии;
- в качестве начальной терапии у пациентов с сахарным диабетом 2 типа при недостаточной эффективности диетотерапии, физических упражнений и необходимости улучшения контроля гликемии.
Режим дозирования препарата Галвус Мет
Применяют внутрь. Для уменьшения выраженности нежелательных реакций со стороны ЖКТ, характерных для метформина, препарат Галвус Мет® принимают во время еды.
Режим дозирования препарата Галвус Мет® следует подбирать индивидуально в зависимости от эффективности и переносимости терапии. При применении препарата Галвус Мет® не следует превышать рекомендованную максимальную суточную дозу вилдаглиптина (100 мг).
Рекомендуемую начальную дозу препарата Галвус Мет® следует подбирать, учитывая длительность течения СД и показатели гликемии, состояние пациента и уже применявшиеся у пациента схемы лечения вилдаглиптином и/или метформином.
В случае пропуска приема препарата следует принять пропущенную дозу как можно скорее. Не рекомендуется прием двойной дозы препарата в течение 1 суток.
Начальная доза препарата Галвус Мет® при неэффективности монотерапии вилдаглиптином
Терапию препаратом Галвус Мет® можно начинать с одной таблетки дозировкой 50 мг+500 мг 2 раза/сут; после оценки терапевтического эффекта дозу можно постепенно увеличивать.
Начальная доза препарата Галвус Мет® при неэффективности монотерапии метформином
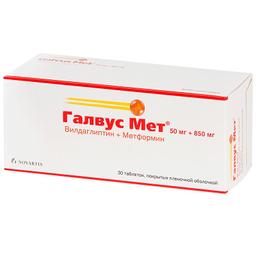
В зависимости от дозы уже принимаемого метформина, лечение препаратом Галвус Мет® можно начинать с одной таблетки дозировкой 50 мг+500 мг, 50 мг+850 мг или 50 мг+1000 мг 2 раза/сут.
Начальная доза препарата Галвус Мет® у пациентов, ранее получавших комбинированную терапию вилдаглиптином и метформином в виде отдельных таблеток
В зависимости от доз уже принимаемых вилдаглиптина или метформина, терапию препаратом Галвус Мет® следует начинать с таблетки, максимально близкой по дозировке к существующему лечению, 50 мг+500 мг, 50 мг+850 мг или 50 мг+1000 мг, и корректировать дозу в зависимости от эффективности.
Стартовая доза препарата Галвус Мет® в качестве начальной терапии у пациентов с СД 2 типа при недостаточной эффективности диетотерапии и физических упражнений
В качестве стартовой терапии препарат Галвус Мет® следует применять в начальной дозе 50 мг+500 мг 1 раз/сут и после оценки терапевтического эффекта постепенно увеличивать дозу до 50 мг+1000 мг 2 раза/сут.
Комбинированная терапия препаратом Галвус Мет® и производными сульфонилмочевины или инсулином
Доза препарата Галвус Мет® рассчитывается, исходя из дозы вилдаглиптина 50 мг 2 раза/сут (100 мг/сут) и метформина в дозе, равной принимаемой ранее в виде монопрепарата.
Пациенты с нарушением функции почек
Перед началом терапии метформинсодержащими препаратами (такими как Галвус Мет®) следует определить СКФ, далее следует контролировать данный показатель не реже 1 раза в год. У пациентов с риском ухудшения уже существующего нарушения функции почек, а также у пожилых пациентов функцию почек следует контролировать чаще, например, каждые 3-6 месяцев.
У пациентов с почечной недостаточностью. средней степени тяжести (с СКФ 30-44 мл/мин/1.73 м2) препарат следует принимать по 1 таблетке в дозе 50 мг + 500 мг 1 раз/сут; с СКФ 45-59 мл/мин/1.73 м2 начальная доза препарата Галвус Мет® - по 1 таблетке в дозе 50 мг + 500 мг или 50 мг + 850 мг, суточная доза препарата не должна превышать 50 мг + 1000 мг – 1 раз/сут. У пациентов с СКФ < 60 мл/мин перед началом терапии метформинсодержащими препаратами (такими как Галвус Мет®) следует оценить факторы, способствующие увеличению риска развития лактат-ацидоза. У пациентов с СКФ < 30 мл/мин применение препарата Галвус Мет® противопоказано, что обусловлено наличием метформина в составе препарата.
В зависимости от текущего состояния функции почек следует соблюдать следующие рекомендации по дозе действующих веществ препарата.
| СКФ, мл/мин | Метформин | Вилдаглиптин |
| 60-89 | Максимальная суточная доза составляет 3000 мг. При ухудшении функции почек на фоне применения следует рассмотреть возможность уменьшения дозы. | Максимальная суточная доза составляет 100 мг. |
| 45-59 | Начальная доза не должна превышать 1000 мг, максимальная суточная доза составляет 2000 мг. | Максимальная суточная доза составляет 50 мг. |
| 30-44 | Начальная доза не должна превышать 500 мг, максимальная суточная доза составляет 1000 мг. | |
| <30 | Применение противопоказано |
Если необходимая доза для одного из 2 действующих веществ не доступна при применении препарата Галвус Мет®, вместо комбинированного препарата следует использовать два отдельных монопрепарата вилдаглиптина и метформина.
Пациенты с нарушением функции печени
Применение препарата Галвус Мет® не рекомендовано пациентам с клиническими или лабораторными признаками нарушения функции печени, включая пациентов с повышением АЛТ или АСТ >3 х ВГН до начала лечения.
Применение у пациентов в возрасте ≥65 лет
Метформин выводится почками. Поскольку у пациентов старше 65 лет часто отмечается нарушение функции почек, дозу препарата Галвус Мет® у данных пациентов следует корректировать, основываясь на показателях функции почек. При применении препарата у пациентов старше 65 лет необходимо регулярно контролировать функцию почек.
Дети
Поскольку безопасность и эффективность препарата Галвус Мет® у детей и подростков младше 18 лет не изучена, применение препарата противопоказано у данной категории пациентов.
Противопоказания к применению препарата Галвус Мет
- повышенная чувствительность к вилдаглиптину и/или к любому из вспомогательных веществ, входящих в состав препарата;
- почечная недостаточность или нарушение функции почек тяжелой степени при скорости клубочковой фильтрации (СКФ) <30 мл/мин/1.73 м2;
- острые состояния с риском развития нарушения функции почек: дегидратация (повторная рвота, при диарее, рвоте), лихорадка, тяжелые инфекционные заболевания, состояния гипоксии (шок, сепсис, инфекции почек, бронхолегочные заболевания);
- клинически выраженные проявления острых или хронических заболеваний, которые могут приводить к развитию тканевой гипоксии (в т.ч. острая сердечная недостаточность, хроническая сердечная недостаточность с нестабильными показателями гемодинамики, дыхательная недостаточность, острый инфаркт миокарда);
- нарушения функции печени, включая пациентов с повышенной активностью печеночных ферментов (АЛТ или АСТ в 3 и более раз выше ВГН (3×ВГН). Поскольку у пациентов с нарушением функции печени в ряде случаев отмечался лактацидоз, возможно, являющийся одной из нежелательных реакций (НР) метформина, препарат Галвус Мет® не следует применять у пациентов с заболеваниями печени или нарушениями биохимических показателей функции печени;
- диабетический кетоацитоз; диабетическая прекома, кома. Диабетический кетоацидоз следует корректировать инсулинотерапией;
- лактатацидоз (в т.ч. в анамнезе);
- прием препарата в течение 48 ч до и не менее 48 ч после проведения радиоизотопных или рентгенологических исследований с внутрисосудистым введением йодсодержащего контрастного вещества;
- обширные хирургические операции и травмы, когда показано проведение инсулинотерапии;
- беременность;
- период грудного вскармливания;
- сахарный диабет 1 типа;
- хронический алкоголизм, острая алкогольная интоксикация;
- соблюдение низкокалорийной диеты (менее 1000 ккал/сут);
- возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности применения препарата у детей и подростков до 18 лет).
С осторожностью
- у пациентов с наличием панкреатита в анамнезе;
- у пациентов в возрасте старше 60 лет, выполняющих тяжелую физическую работу, в связи с повышенным риском развития у них лактат-ацидоза;
- у пациентов с почечной недостаточностью с СКФ 30-59 мл /мин/1.73 м2.
У пациентов, получающих лечение инсулином, препарат Галвус Мет® не может заменить инсулинотерапию. Препарат Галвус Мет® не следует применять для лечения СД 1 типа или диабетического кетоацидоза.
Побочное действие препарата Галвус Мет
Вилдаглиптин+метформин
Представленные ниже данные относятся к применению вилдаглиптина и метформина в монотерапии и в комбинации.
Отмечены редкие случаи развития ангионевротического отека на фоне терапии препаратом со сходной частотой в контрольной группе. Наиболее часто случаи ангионевротического отека отмечались при применении препарата в комбинации с ингибиторами АПФ. В большинстве случаев ангионевротический отек был легкой степени и разрешался самостоятельно в ходе продолжения терапии вилдаглиптином.
На фоне терапии вилдаглиптином редко отмечались нарушения функции печени (включая гепатит) бессимптомного течения. В большинстве случаев данные нарушения и отклонения показателей функции печени от нормы разрешались самостоятельно без осложнений после прекращения терапии препаратом. При применении вилдаглиптина в дозе 50 мг 1 или 2 раза/сут частота повышения активности печеночных ферментов АЛТ или АСТ в 3 раза выше ВГН составляла 0.2% или 0.3% соответственно (по сравнению с 0.2% в контрольной группе). Повышение активности печеночных ферментов в большинстве случаев было бессимптомным, не прогрессировало и не сопровождалось холестазом или желтухой.
Вилдаглиптин не оказывал влияния на массу тела при добавлении к метформину.
Желудочно-кишечные нарушения при применении метформина регистрируются очень часто. Частота НР со стороны ЖКТ на фоне комбинированной терапии вилдаглиптином и метформина гидрохлоридом составляла 13.2% (при применении в дозе 50 мг 1 раз/сут или 2 раза/сут). При применении монотерапии метформина - 18.1%.
Ниже приведены нежелательные реакции (НР), возможные как при применении комбинированной терапии вилдаглиптином и метформином, так и монопрепаратов вилдаглиптина и метформина.
НР распределены по системно-органным классам в соответствии со словарем для регуляторной деятельности MedDRA, с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000).
Со стороны обмена вещества: часто – гипогликемия.
Со стороны нервной системы: часто – тремор, головная боль, головокружение; нечасто – повышенная утомляемость.
Со стороны ЖКТ: часто – тошнота.
Долгосрочные клинические исследования продолжительностью до 2 лет не выявили каких-либо изменений профиля безопасности или непредвиденных рисков при применении вилдаглиптина в комбинации с метформином.
Изучение применения комбинации вилдаглиптин + метформин в качестве стартовой терапии при сахарном диабете 2 типа не выявило отклонений профиля безопасности или непредвиденных рисков.
В комбинации с инсулином
В контролируемых клинических исследованиях при применении вилдаглиптина в дозе 50 мг 2 раза/сут в комбинации с инсулином в сочетании с метформином или без него, частота отмены терапии в связи с развитием побочных реакций составила 0.3% в группе вилдаглиптина, при этом в группе плацебо случаев отмены терапии не было.
Частота гипогликемии была сопоставимой в обеих группах (14.0% в группе вилдаглиптина и 16.4% в группе плацебо). В группе вилдаглиптина отмечены случаи гипогликемии тяжелой степени у двух пациентов, в группе плацебо – у 6 пациентов.
На момент завершения исследования вилдаглиптин не оказывал влияния на среднюю массу тела (масса тела увеличена на +0.6 кг по сравнению с исходной в группе вилдаглиптина, в группе плацебо изменений не отмечено).
НР у пациентов, получавших вилдаглиптин 50 мг 2 раза/сут в комбинации с инсулином (с метформином или без него), представлены ниже.
Со стороны нервной системы: часто – головная боль.
Со стороны ЖКТ: часто – тошнота, гастроэзофагеальный рефлюкс; нечасто – диарея, метеоризм.
Лабораторные и инструментальные данные: часто – снижение концентрации глюкозы в крови.
Общие нарушения: часто – озноб.
В комбинации с препаратами сульфонилмочевины
Случаев отмены препарата, связанных с развитием НР в группе комбинированной терапии вилдаглиптином, метформином и глимепиридом, отмечено не было. В группе комбинированной терапии плацебо, метформином и глимепиридом частота НР составила 0.6%.
Гипогликемия отмечалась часто в обеих группах (5.1% в группе комбинированной терапии вилдаглиптином, метформином и глимепиридом и 1.9% в группе комбинированной терапии плацебо, метформином и глимепиридом). В группе вилдаглиптина отмечен один эпизод гипогликемии тяжелой степени.
На момент завершения исследования значимого влияния на массу тела выявлено не было (+0,6 кг в группе вилдаглиптина и -0,1 кг в группе плацебо).
НР у пациентов, получавших вилдаглиптин 50 мг 2 раза/сут в комбинации с метформином и препаратами сульфонилмочевины, представлены ниже.
Со стороны нервной системы: часто – головокружение, тремор.
Со стороны обмена веществ: часто – гипогликемия.
Со стороны кожи и подкожных тканей: часто – гипергидроз.
Общие нарушения: часто – астения.
Вилдаглиптин в качестве монотерапии
Инфекции и инвазии: очень редко – инфекции верхних дыхательных путей, назофарингит.
Со стороны обмена веществ: нечасто – гипогликемия.
Со стороны нервной системы: часто – головокружение; нечасто – головная боль.
Со стороны ЖКТ: нечасто – запор.
Со стороны скелетно-мышечной системы и соединительной ткани: нечасто – артралгия.
Со стороны сосудов: нечасто – периферические отеки.
При применении комбинированной терапии вилдаглиптином и метформином не отмечалось клинически значимого повышения частоты вышеуказанных НР, отмечавшихся при приеме вилдаглиптина.
На фоне монотерапии вилдаглиптином 50 мг 1 раз/сут частота отмены терапии по причине НР составила 0.2%, 50 мг 2 раза/сут 0.1%, а в группе плацебо – 0.6%, в группе препарата сравнения – 0.5%.
В исследовании монотерапии вилдаглиптином частота развития гипогликемии составляла 0.5% среди пациентов, получавших вилдаглиптин 50 мг 1 раз/сут и 0.3% - 50 мг 2 раза/сут, по сравнению с 0.2% в группах плацебо и препарата сравнения. Серьезных и тяжелых НР не было выявлено.
Монотерапия вилдаглиптином не оказывала влияния на массу тела.
Долгосрочные клинические исследования продолжительностью до 2 лет не выявили каких-либо дополнительных отклонений профиля безопасности или непредвиденных рисков при применении вилдаглиптина в монотерапии.
Пострегистрационные исследования
Со стороны ЖКТ: частота неизвестна – панкреатит.
Со стороны печени и желчевыводящих путей: частота неизвестна – гепатит (разрешившийся самостоятельно после отмены лекарственного препарата), повышение активности печеночных ферментов (разрешившееся самостоятельно после отмены лекарственного препарата), холецистит.
Со стороны скелетно-мышечной системы и соединительной ткани: частота неизвестна – миалгия, артралгия, в редких случаях выраженная.
Со стороны кожи и подкожных тканей: частота неизвестна – крапивница, эксфолиативное и буллезное поражения кожи, включая буллезный пемфигоид, кожный васкулит.
Метформин в монотерапии
Со стороны обмена веществ: очень часто – снижение аппетита; очень редко – лактатацидоз.
Со стороны ЖКТ: очень часто – метеоризм, тошнота, рвота, диарея, боль в животе; часто – дисгевзия.
Со стороны печени и желчевыводящих путей: очень редко – гепатит.
Со стороны кожи и подкожных тканей: очень редко – кожные реакции (в частности, эритема, зуд, крапивница).
Лабораторные и инструментальные данные: очень редко – уменьшение всасывания витамина B12, изменение показателей функции печени.
Уменьшение всасывания витамина B12 и снижение его концентрации в сыворотке крови на фоне применения метформина отмечалось очень редко у пациентов, получавших препарат в течение длительного времени, и, как правило, не представляло клинического значения. Следует учитывать возможность уменьшения всасывания витамина B12 у пациентов с мегалобластной анемией.
Отдельные случаи отклонения лабораторных показателей функции печени от нормы или случаи гепатита, которые наблюдались на фоне применения метформина, разрешались после его отмены.
Сообщение о нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения "польза-риск" лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
Сертификаты